
А.Н.Пархоменко, О.И.Иркин, Я.М.Лутай, В.Е.Вовченко, С.П.Кушнир
Отдел реанимации и интенсивной терапии ННЦ «Институт кардиологии имени акад. Н. Д. Стражеско» НАМН УкраиныОдним из наиболее грозных и молниеносных осложнений острого Q-инфаркта миокарда (ИМ), является разрыв наружной стенки сердца. Данное осложнение, как правило, ведет к развитию тампонады сердечной сумки, электромеханической диссоциации и быстрой смерти больного. Вероятность наружного разрыва после острого инфаркта миокарда до внедрения реперфузионной терапии составляла от 4% до 6% (1). Широкое использование тромболитической терапии и особенно механических методов реперфузии, а также современная стратегия медикаментозного лечения позволили сократить частоту этого осложнения до 0,5-3% (2-5). Известными факторами риска разрыва свободной стенки левого желудочка (ЛЖ) являются возраст, женский пол и передняя локализация ИМ (3). В регистре GRACE риск разрыва сердца был выше также у пациентов с исходно высокой частотой сердечных сокращений, низким систолическим АД и перенесших острое нарушение мозгового кровообращения. Маркером разрыва миокарда является также значительное повышение исходного уровня С-реактивного белка (6). В то же время использование первичной ангиопластики, низкомолекулярных гепаринов и бета-адреноблокаторов в течение первых 24 часов, а также ИМ в анамнезе ассоциировались с меньшей вероятностью развития данного осложнения (4). Как правило, разрыв свободной стенки ЛЖ манифестирует в течение первой недели от развития острого инфаркта миокарда. Однако, не каждый разрыв наружной стенки миокарда заканчивается летально. Клиническая картина зависит от объема и скорости поступления крови в полость перикарда. Подострые варианты разрыва встречаются примерно в трети случаев и характеризуются повторными поступлениями небольших количеств крови в полость перикарда через прикрывающийся дефект свободной стенки ЛЖ (7). В таком случае быстрое хирургическое вмешательство может спасти жизнь пациенту. Постепенное развитие патологического процесса возможно также при условии образования спаек между наружным и внутренним листками перикарда. Вследствие этого возникает полость, ограниченная перикардиальными спайками, что в случае наружного разрыва препятствует развитию тампонады сердца (Рис.1).
Подобный механизм является основой для формирования псевдоаневризмы ЛЖ. Аневризматический мешок псевдоаневризмы состоит из перикарда, ограниченного спайками и остатков разорвавшейся стенки ЛЖ. Полость псевдоаневризмы увеличивается в размерах в связи с постоянным поступлением крови, поэтому по объему иногда она может превышать объем ЛЖ. Учитывая выраженную турбулентность и снижение скорости кровотока в полости псевдоаневризмы, по краям ее, как правило, происходит образование тромба. Псевдоаневризма чаще развивается при инфаркте миокарда задней локализации (8). В тоже время по данным David и соавт. разрывы миокарда с формированием псевдоаневризмы наиболее часто встречаются при боковой локализации инфаркта (9).
В большинстве случаев псевдоаневризмы обнаруживают у асимптомных пациентов после перенесенного ИМ при плановом проведениии эхокардиографии или при обследовании пациентов по поводу прогрессирования сердечной недостаточности, нарушений сердечного ритма, эмболий или стенокардии. В настоящее время именно эхокардиография (трансторакальная или трансэзофагальная) является основным методом диагностики псевдоаневризм (10). Однако иногда это осложнение обнаруживают при проведении компьютерной томографии, вентрикулографии, магниторезонасной томографии или интраоперационно при проведении аорто-коронарного шунтирования (11). Псевдоаневризмы внешне могут быть похожи на истинные аневризмы, что может представлять определенные трудности при диагностике. Чаще всего только псевдоаневризмы небольшого размера совместимы с жизнью. При диагностике таких псевдоаневризм регистрируется, как правило, тонкий перешеек.
При псевдоаневризме одна из стенок ЛЖ состоит только лишь из тромботических масс и перикарда, поэтому риск ее разрыва очень велик и составляет по данным разных исследований от 30 до 45% (12). Причем разрыв стенки может произойти в любой момент и предугать его развитие не представляется возможным. Поэтому в большинстве случаев при псевдоаневризме выбирают хирургического тактику лечения. В целом ведение пациентов представляется следующим образом:
– при диагностике псевдоаневризмы в течении первых 2-3 месяцев от развития острого ИМ – необходимо безотлагательное проведение хирургического вмешательства, так как риск разрыва очень велик;
– при диагностике псевдоаневризмы через год и более после ИМ – выбор тактики определяется симптоматикой заболевания (13), размером псевдоаневризмы и наличием противопоказаний для проведения хирургического вмешательства.
Пациенты с хроническими асимптомными псевдоаневризмами диаметром менее 3 см и без склонности к увеличению могут вестись медикаментозно (14). По данным Moreno и соавт. при консервативной тактике ведения из 10 пациентов в течение 4 лет наблюдения от сердечно-сосудистых причин умер только 1 пациент, однако у 3 больных отмечалось развитие ишемического инсульта. При выборе такой тактики лечения для профилактики тромбоэмболических осложнений обязательным является назначение длительной антикоагулянтной терапии. В качестве альтернативы консервативной тактике ведения у пациентов с высоким риском хирургического вмешательства и тонким перешейком псевдоаневризмы возможно проведение черезкожной процедуры с постановкой заплаты, перекрывающей сообщение полости псевдоаневризмы и полости ЛЖ (16).
С практический точки зрения предпочтение хирургическому методу лечения также связано с тем, что основная масса пациентов с разрывом свободной стенки ЛЖ имеют поражение 2 и более коронарных артерий и нуждаются в проведении аорто-коронарного шунтирования. (10, 13, 17).
Исход оперативного вмешательства зависит от многих факторов: общее состояние пациента, выраженность сердечной недостаточности, размер инфаркта миокарда, сопутствующие заболевания и т.д. Летальность после оперативного вмешательства колеблется в пределах 23-35% (18-20).
В настоящий время число описаний псевдоаневризм небольшое и данные о клиническом течении заболевания невелики. В настоящем сообщении мы хотели бы представить случай эхокардиографической диагностики псевдоаневризмы ЛЖ больших размеров с последующим успешным хирургическим лечением.
Пациент С., 50 лет поступил в отделение реанимации и интенсивной терапии ННЦ «Институт кардиологии имени акад. Н.Д.Стражеско» 16.04.08 с диагнозом острого повторного ИМ (15.04.08). В анамнезе у больного Q ИМ в области задне-диафрагмальных отделов ЛЖ от 28.01.08, по поводу которого он прошел стационарное лечение и реабилитацию. Находился на постоянной поддерживающей терапии β-блокаторами, статинами, антитромбоцитарными препаратами. 15.04.08 у пациента развился интенсивный ангинозный приступ со снижением АД, по поводу которого он был госпитализирован в отделение интенсивной терапии больницы по месту жительства. В связи с невозможностью стабилизации состояния 16.04.08 пациент переведен в Институт кардиологии.
Несмотря на проводимую терапию (нитраты, диуретики, статины, ингибиторы-АПФ, антикоагулянты, дезагреганты, антиаритмические препараты), состояние пациента оставалось тяжелым. На протяжении двух суток больной находился в состоянии кардиогенного шока, отмечались явления рецидивирующего отека легких. Параметры центральной гемодинамики поддерживали при помощи инфузии симпатомиметиков (добутамина и допамина). У больного в динамике наблюдалось повышение с последующим закономерным снижением уровня кардиоспецифических ферментов (общая КФК от 1708 МЕ/л до 184 МЕ/л (N 35-200 МЕ/л) и АСТ от 107 МЕ/л до 37 МЕ/л (N 11-40 МЕ/л) в течение 5 суток наблюдения). За время наблюдения значимых изменений в показателях гемоглобина, эритроцитов и тромбоцитов не отмечалось. Сохранялся лейкоцитоз от 12,5 до 13,4 *10 9/л в течение всего периода наблюдения. Показатели функции почек (креатинин-106 мкмоль/л, скорость клубочковой фильтрации – 85,6 мл/мин) были близки к нормальным значениям. Показатели электролитного баланса не выходили за пределы нормальных значений. Уровень глюкозы находился в пределах 6,2-6,4 ммоль/л. Показатели коагулограммы (тромбиновое время, свободный гепарин и фибриноген) за время наблюдения существенно не менялись.
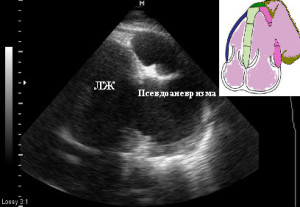
По данным ЭХО-КГ за 17.04.08 у больного отмечается дефект боковой и заднебоковой стенки ЛЖ с формированием псевдоаневризмы (приблизительный объем около 200 мл). Полость пседоанеризмы содержит большое количество тромбов, которые в основном локализуются по ее краям, наблюдается феномен спонтанного контрастирования кровотока. Большое количество эхопозитивных спаек перикарда. (Рис.3)
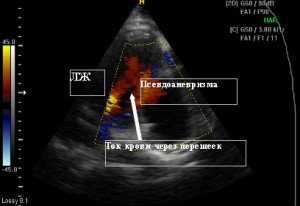
Отмечен массивный сброс крови из левого желудочка через перешеек в полость псевдоаневризмы. (Рис.4)
18.04.08 на фоне проводимой терапии удалось стабилизировать состояние пациента. Отменена инфузия прессорных аминов. Уровень систолического АД контролировался в пределах 90-100 мм рт. ст. Начата терапия бета-адреноблокаторами. У больного не рецидивировали боли ангинозного характера, однако сохранялись явления ОЛЖН (Killip 2).
Повторное эхокардиографическое исследование 21.04.08 не выявило увеличения полости псевдоаневризмы либо прогрессирования разрыва свободной стенки ЛЖ. В связи со стабилизацией гемодинамической ситуации пациент был проконсультирован кардиохирургом и 22.04.08 перведен в Институт сердечно-сосудистой хирургии имени Н. М. Амосова с целью проведения оперативного лечения. На момент перевода состояние пациента оставалось стабильным, боли ангинозного характера не беспокоили, признаков ОЛЖН не было.
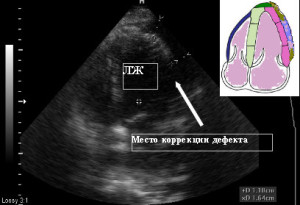
23.04.08 больному было проведена резекция аневризмы (псевдоаневризмы) левого желудочка с тромбэктомией и пластикой разрыва боковой стенки левого желудочка, аортального клапана. Операция прошла успешно и для дальнейшего лечения и реабилитации больной был переведен в ННЦ «Институт кардиологии имени академика Н. Д. Стражеско». Повторная ЭХО-КГ после проведенной операции свидетельствовала об отсутствии дефекта и удовлетворительном состоянии гемодинамики (Рис.5).
Представленный случай успешной прижизненной диагностики и лечения наружного разрыва миокарда левого желудочка с формированием гигантской псевдоаневризмы левого желудочка показывает возможность поддержания сердечной деятельности при своевременном оказании неотложной помощи. При этом ранняя эхокардиографическая диагностика, уже в отделении интенсивной терапии и реанимации, позволила своевременно спланировать и провести успешную хирургическую коррекцию, что в итоге сохранило жизнь пациента.
Литература:
1. Dellborg M, Held P, Swedberg K, Vedin A. Rupture of the myocardium. Occurrenceand risk factors. Br Heart J 1985;54:11–16.
2. Ikeda N, Yasu T, Kubo N, Hirahara T, Sugawara Y, Kobayashi N, et al. Effect of reperfusion therapy on cardiac rupture after myocardial infarction [in Japanese]. Circ J 2004;68:422-6.
3. Moreno R, Lo´pez de Sa´ E, Lopez-Sendon JL, et al. Free wall rupture in patients with acute myocardial infarction treated with primary angioplasty. Incidence and related factors. Am J Cardiol 2000; 85: 757–760
4. Lopez-Sendon J., Gurfinkel E.P., Lopez de Sa E. et al. Factors related to heart rupture in acute coronary syndromes in the Global Registry of Acute Coronary Events. Eur Heart J (2010) 31 (12): 1449-1456.
5. Yip HK, Wu CJ, Chang HW, Wang CP, Cheng CI, Chua S, Chen MC. Cardiac rupture complicating acute myocardial infarction in the direct percutaneous coronary intervention reperfusion era. Chest 2003;124:565–571.
6. Anzai T, Yoshikawa T, Shiraki H, Asakura Y, Akaishi M, Mitamura H, Ogawa S. C-reactive protein as a predictor of infarct expansion and cardiac rupture after a first Q wave acute myocardial infarction. Circulation. 1997;96:778–784
7. Purcaro A, Costantini C, Ciampani N, et al. Diagnostic criteria and management of subacute ventricular free wall rupture complicating acute myocardial infarction. Am J Cardiol 1997;80:397-405.
8. Malcolm ID, Fitchett DH, Stewart D, Marpole D, Symes J. Ventricular aneurysm: false or true? An important distinction. Ann Thorac Surg 1980;29:474-477.
9. David TE. Surgery for postinfarction rupture of the free wall of the ventricle. In: David TE, editor. Mechanical complications of myocardial infarction. Austin: RG Landes; 1993. p. 142-51.
10. Atik FA, Navia JL, Vega PR, Gonzalez-Stawinski GV, Alster JM, Gillinov AM, et al. Surgical treatment of postinfarction left ventricular pseudoaneurysm. Ann Thorac Surg 2007;83: 526–31
11. Fedakar A., Bugra O., Onk A., et al. Repair of Left Ventricular Pseudoaneurysms. Asian Cardiovasc Thorac Ann. 2010; 18:39-43
12. Vlodaver Z, Coe JI, Edwards JE. True and false left ventricular aneurysms: propensity for the latter to rupture. Circulation 1975;51:567-72.
13. Eren E, Bozbuga N, Toker ME, Keles C, Rabus MB, Yildirim O, et al. Surgical treatment of post-infarction left ventricular pseudoaneurysm: a two-decade experience. Tex Heart Inst J 2007;34:47–51.
14. Pretre R, Linka A, Jenni R, Turina MI. Surgical treatment of acquired left ventricular pseudoaneurysms. Ann Thorac Surg 2000;70:553–7.
15. Moreno R, Gordillo E, Zamorano J, Almeria C, Garcia-Rubira JC, Fernandez-Ortiz A, et al. Long term outcome of patients with postinfarction left ventricular pseudoaneurysm. Heart 2003;89:1144–6.
16. Clift P, Thorne S, de Giovanni J. Percutaneous device closure of pseudoaneurysm of the left ventricular wall. Heart 2004;90:e62.
17. Reardon MJ, Carr CL, Diamond A, et al. Ischemic left ventricular free wall rupture: prediction, diagnosis, and treatment. Ann Thorac Surg 1997;64:1509-13.
18. Komeda M, David TE. Surgical treatment of postinfarction false aneurysm of the left ventricle. J Thorac Cardiovasc Surg 1993;106:1189-91.
19. Prête R, Linka A, Jenni R, Turina MI. Surgical treatment of acquired left ventricular pseudoaneurysms. Ann Thorac Surg 2000; 70: 553-557.
20. Frances C, Romero A, Grady D. Left ventricular pseudoaneurysm. J Am Coll Cardiol 1998;32:557–61.


 26 Березня 2013
26 Березня 2013  admin
admin 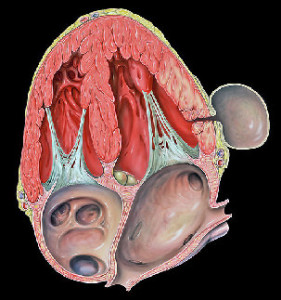
 Рубрика:
Рубрика: 